グアニン四重鎖の細胞内可視化プローブ開発
東京農工大学 安田瑞穂・馬 悦・寺 正行・長澤和夫
Mizuho Yasuda, Yue Ma, Sachiko Okabe, Yuki Wakabayashi, Dongdong Su, Young-Tae Chang, Hiroyuki Seimiya, Masayuki Tera, Kazuo Nagasawa
Target identification of a macrocyclic hexaoxazole G-quadruplex ligand using post-target-binding visualization
Chem. Commun. 2020, 56, 12905-12908. DOI:10.1039/D0CC04957C
https://pubs.rsc.org/en/content/articlelanding/2020/cc/d0cc04957c#!divAbstract
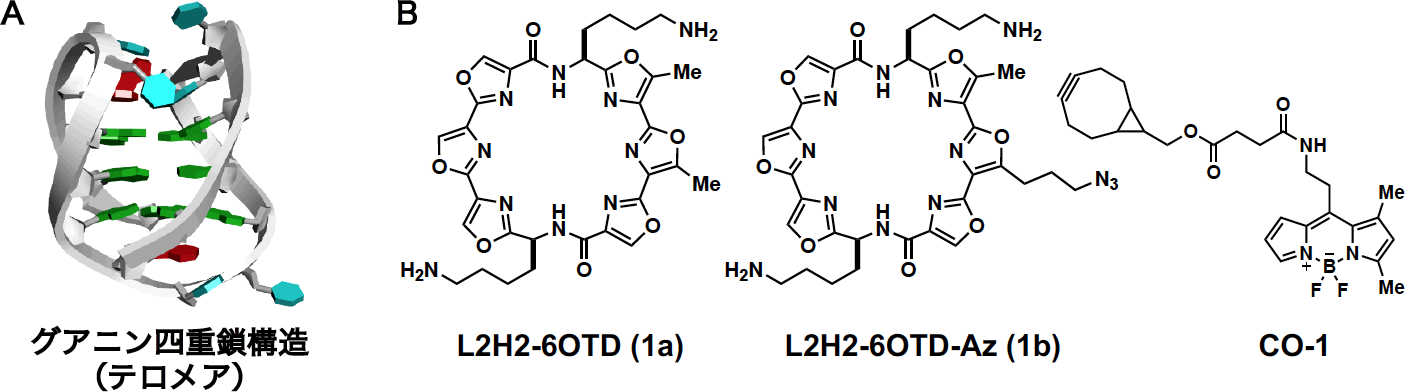
1981年以降、日本における死因第一位の疾病である「がん」は遺伝子疾患の一つであり、DNAやRNAそのものが、がん抑制のための標的となり得ます。グアニン四重鎖 (G4、図1A) は、DNAやRNA上のグアニン豊富な核酸配列で形成される特異な高次構造として近年注目されています。次世代シーケンサーによる解析から、ヒトゲノム上には約70万以上の配列でG4構造を形成する可能性のある配列が存在すると示唆されています。特に、CpGアイランドやがん遺伝子のプロモーター領域ではその存在が多く認められることから、G4はがん関連遺伝子の発現調整に大きく関わると考えられています。しかしG4は、一本鎖配列との平衡状態にあり、生体内では動的に形成されることから、上述のようながんを中心とする生命現象とG4形成との直接的な関連は未だ不明な点が数多くあります。
当研究室ではこれまで、G4と選択的かつ強力に相互作用し安定化する大環状オキサゾール化合物(OTD)をG4リガンドとして開発し、数多くの誘導体を合成しています。これらの化合物の中で、二本のアミノブチル側鎖を有するL2H2-6OTD(1a、図1B)はG4の安定化を介してがん細胞増殖抑制活性を示すと考えられていますが、細胞内においてG4を標的としているかは明らかになっていませんでした。
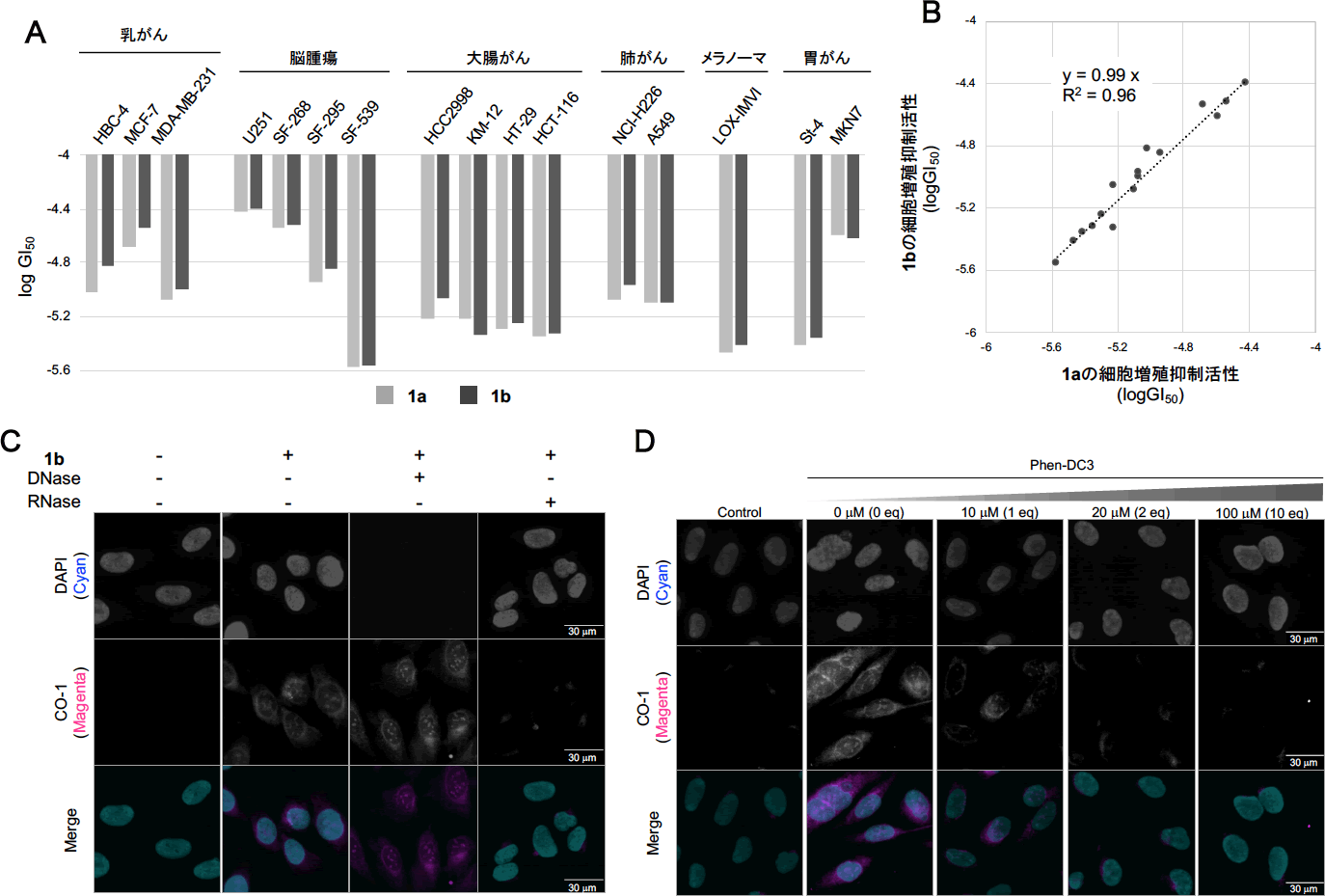
そこで本研究では、1aのポスト蛍光修飾を行うことで、1aの細胞内における分子標的を調べることとしました。即ち、1aに蛍光プローブを導入するための足がかりとなるアジド基をOTD骨格の側鎖に導入したL2H2-6OTD-Az(1b、図1B)を合成しました。なおアジド基は、細胞環境下においても高収率かつ高官能基選択的にHuisgen環化反応によりアルキンと反応し、トリアゾールを形成する官能基として汎用されています。本反応を活用することで、細胞内で蛍光基の導入と分子標的探索が可能となります(後述)。それに先立ちまず1bが、1aのがん細胞増殖抑制活性を維持していることを確認するため、分子プロファイリング支援活動班にJFCR39パネルによる化合物の細胞増殖抑制活性評価を委託しました。その結果、1bは1aと同様の細胞増殖抑制活性を示すことがわかりました(図2A、2B)。そこで1bを用い、細胞内における分子標的の探索を行いました。1bで処理した細胞に対して、アルキンを持つ蛍光プローブであるCO-1(図1B)を添加したところ、細胞質においてCO-1由来の蛍光を観察することができました。ついでこの細胞をDNaseあるいはRNaseを用いて酵素処理したところ、RNase処理した細胞のみCO-1由来の蛍光が消失しました。このことから、1bは細胞内においてRNA由来の核酸と結合していることが示唆されました(図2C)。さらに、OTDと同様の結合様式でG4と相互作用するG4リガンドであるPhen-DC3を用い、細胞内での競合実験を行いました。その結果、Phen-DC3の濃度依存的にCO-1由来の蛍光が減弱したことから(図2D)、1bや1aは細胞内においてRNA配列で形成されるG4(RNA G4)を標的とすることが示唆されました。
本研究成果を起点とし、G4に由来する制がんメカニズムの解析、またG4を標的とするより効果的な制がん剤の開発に向け、さらに研究を進めていきたいと考えています。
図1
A:グアニン四重鎖(G4)構造,
B:G4リガンドL2H2-6OTD(1a),L2H2-6OTD-Az(1b)およびCO-1の構造
図2
A:JFCR39パネルによる1aおよび1bの細胞増殖抑制活性評価(抜粋),
B:1aおよび1bの癌細胞株と細胞増殖抑制活性の相関,
C:ヌクレアーゼ(DNaseまたはRNase)の存在下または非存在下での固定細胞(U2OS)との1bおよびCO-1のHuisgen環化反応におけるCO-1由来の蛍光検出,
D:Phen-DC3処理(0〜100 μM)による固定細胞(U2OS)での1bとCO-1のHuisgen環化反応におけるCO-1由来の蛍光変化