核内RNA分解による細菌感染応答
―サルモネラ感染時において核内RNA分解機構を介して免疫応答を引き起こす
千葉大学 大学院薬学研究院 今村 亮俊
Katsutoshi Imamura, Akiko Takaya, Yo-Ichi Ishida, Yayoi Fukuoka, Toshiki Taya, Ryo Nakaki, Miho Kakeda, Naoto Imamachi, Aiko Sato, Toshimichi Yamada, Rena Onoguchi-Mizutani, Gen Akizuki, Tanzina Tanu, Kazuyuki Tao, Sotaro Miyao, Yutaka Suzuki, Masami Nagahama, Tomoko Yamamoto, Torben Heick Jensen, Nobuyoshi Akimitsu
Diminished nuclear RNA decay upon Salmonella infection upregulates antibacterial noncoding RNAs.
EMBO Journal, 37(13) DOI: 10.15252/embj.201797723 (2018)
https://www.embopress.org/doi/full/10.15252/embj.201797723
細胞質のmRNA量の動的な量の変化は、分解過程を介して厳密に制御されており、様々な生物学的プロセスの制御に重要であることが明らかにされている。このような反応の中には、感染時に病原体を排除するための遺伝子発現を制御するものも存在している。しかし、このような制御が核内RNAの分解にも及んでいるかどうかは不明であった。
RNAの中には、タンパク質をコードしない非コードRNAが存在する。なかでも、核内に存在する非コードRNAは様々な場面で遺伝子発現調整に関与していることが報告されている。本研究では、これらの核内非コードRNAの分解過程が、生体反応においてどのような影響を持っているかを調べるために、細胞内寄生細菌の1つであるサルモネラに焦点を当てた。
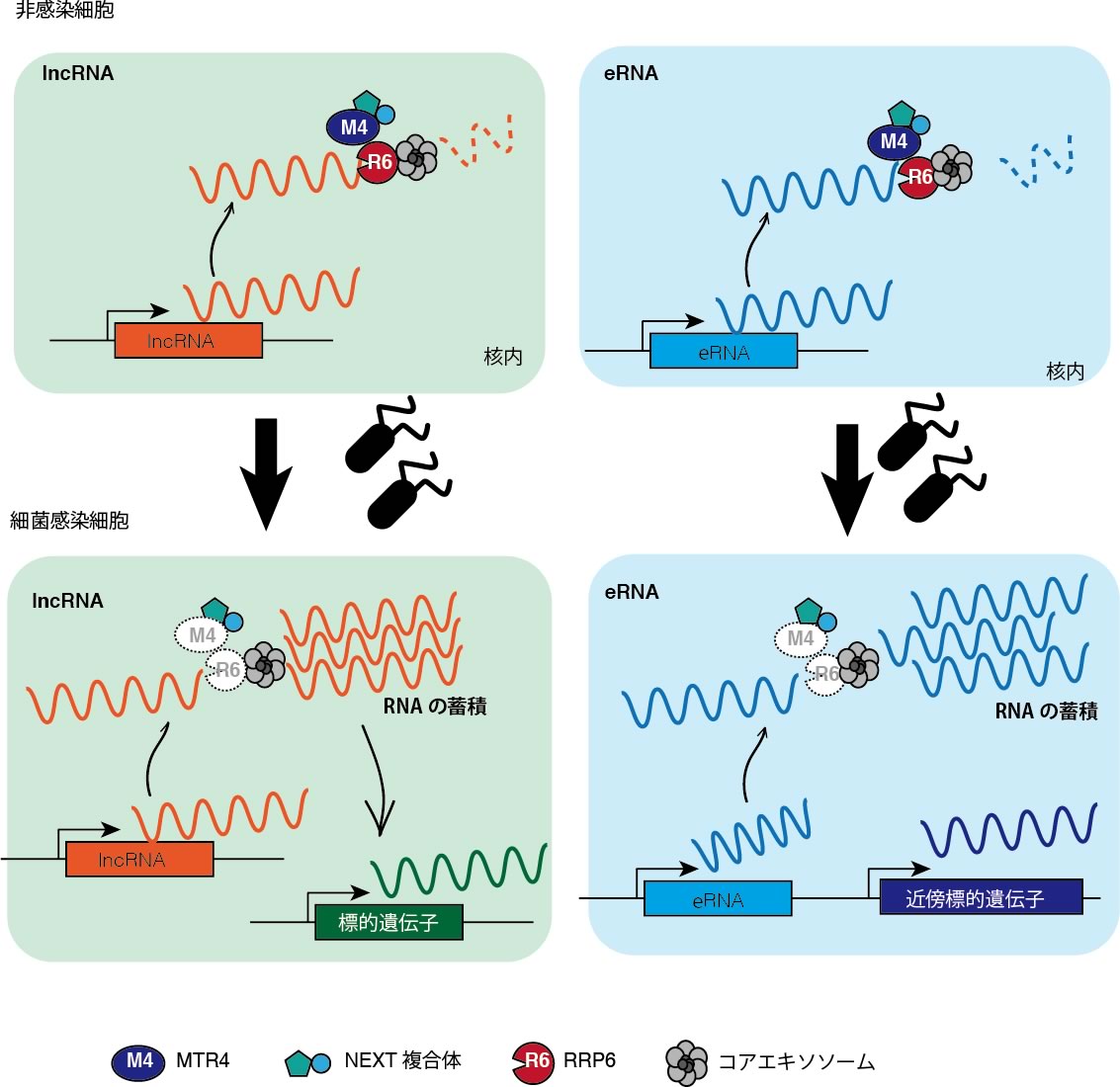
まず筆者らは、核内に存在する短寿命非コードRNAを同定した(14,754個)。その中で、サルモネラ感染に応答して発現上昇する遺伝子群を同定するために、サルモネラ感染後2,6,18時間で細胞からRNAを回収し、RNA-seqによりトランスクリプトーム解析を行った。その結果、サルモネラ感染で発現上昇する短寿命非コードRNAを145個発見した。これらは、熱処理サルモネラやLPS,フラジェリンでは発現上昇しなかった。RNAポリメラーゼ2のクロマチン免疫沈降解析とRNA分解速度を測定した結果、多くの短寿命核内非コードRNAがサルモネラ感染で分解抑制され, 蓄積していることがわかった.
これまでに、核内RNA分解に関与する複合体として、エキソソームと基質認識に関与するNEXT複合体とPAXT複合体が見つかっている。しかしながら, 今回我々が発見した短寿命核内非コードRNAが既知の複合体によって壊されているかは不明であったので、ノックダウン実験によって確認した。代表として、エンハンサーRNA2種類、核内長鎖非コードRNA2種類について、qPCRで確認した結果、4種すべてエキソソームノックダウンで発現量が上昇した。また、エンハンサーRNAに関しては、NEXT複合体の構成タンパク質であるMTR4, RBM7, ZCCHC8それぞれのノックダウンで発現上昇したことから、NEXT複合体が分解に関与していることがわかった. 一方で、核内長鎖非コードRNAについては、MTR4, ZCCHC8ノックダウンでは発現が上昇したが、RBM7ノックダウンでは発現が上昇しなかったことから、NEXT複合体とは異なったMTR4, ZCCHC8を含む複合体によって分解が制御されている可能性が残る。
サルモネラ感染でRNA分解が抑制されるメカニズムを明らかにする目的で、まず、サルモネラ感染で核内RNA分解タンパク質の量的変動があるか否かをWBで確認した。その結果、驚くべきことにMTR4とRRP6が感染後消失していることを発見した。MTR4が消失していることから、NEXT複合体が壊れていると考えられたので、グリセロールグラジエントにより、複合体形成について確認した。その結果、サルモネラ感染細胞ではNEXT複合体構成タンパク質であるRBM7, ZCCHC8が非感染細胞に比べ、軽いフラクションに検出された. さらに、qPCRによって、MTR4, RRP6のmRNAレベルは非感染とサルモネラ感染細胞で変化がなかった. 以上の結果から, サルモネラ感染によって, MTR4とRRP6がタンパク質レベルで分解し、エキソソームによる核内RNA分解が抑制されていることがわかった。本支援より得られたsiRNAを用いて、サルモネラ感染によって引き起こされるMTR4とRRP6の分解経路の特定を試みたところ、p38のリン酸化経路が関与していることを示唆するデータを得た。MTR4とRRP6の分解経路の特定の詳細は更なる検討が必要で、今後の研究課題である。
サルモネラ感染によって, 短寿命核内非コードRNAの分解が抑制され、蓄積することはわかったが、これらの蓄積がサルモネラ感染にどのように影響しているのかは不明であったため、この点について検討をした。まず、核内長鎖非コードRNAの1つであるNEAT1とエンハンサーRNAの1つを代表として用い、それぞれのノックアウト細胞をCRISPR/Cas9システムを用いて作出した。これらにサルモネラを感染させたところ、ノックアウト細胞は野生型と比べ死にやすくなった。また、サルモネラのノックアウト細胞への感染効率に差はなかったが、感染後18時間での細胞内の生菌数は、ノックアウト細胞の方が顕著に上昇していた。短寿命核内非コードRNAは、さまざまな様式で下流の遺伝子発現を制御している。例えば、NEAT1は、転写調節因子であるSFPQなどの局在をゲノムとNEAT1が形成する核内構造体パラスペックルとで変化させることで遺伝子発現を制御している。またエンハンサーRNAは、これらが発現するエンハンサー領域が制御する近傍のmRNAの発現を制御していると考えられている。そこで、サルモネラ感染時に、短寿命核内非コードRNAが制御している遺伝子群をマイクロアレイを用いて解析した。その結果、NEAT1もエンハンサーRNAもサルモネラ感染抵抗性に寄与すると考えられる遺伝子の発現調節に関与していることがわかった。これらの結果から、短寿命核内非コードRNAの蓄積は、宿主細胞の感染抵抗性の獲得に関与していると考えられる。
本研究の結果は、病原性感染に対する応答において核内RNAの制御された分解が基本的な役割を果たしていることを明らかにした。