非形質転換細胞-形質転換細胞間作用を制御する新規抗がん化合物の探索とその機能解析
LonidamineとDomperidoneは非形質転換細胞の運動を抑制することにより形質転換細胞の領域拡大を阻害する
早稲田大学先進理工学研究科
青山 愛、仙波 憲太郎
Aoyama, M., Ishikawa, K., Nemoto, S., Hirano, H., Watanabe, N., Osada, H., Watanabe, S., Semba, K.
Lonidamine and domperidone inhibit expansion of transformed cell areas by modulating motility of surrounding nontransformed cells.
Journal of Biological Chemistry, 298: 1026365(2022). doi: 10.1016/j.jbc.2022.102635 https://doi.org/10.1016/j.jbc.2022.102635
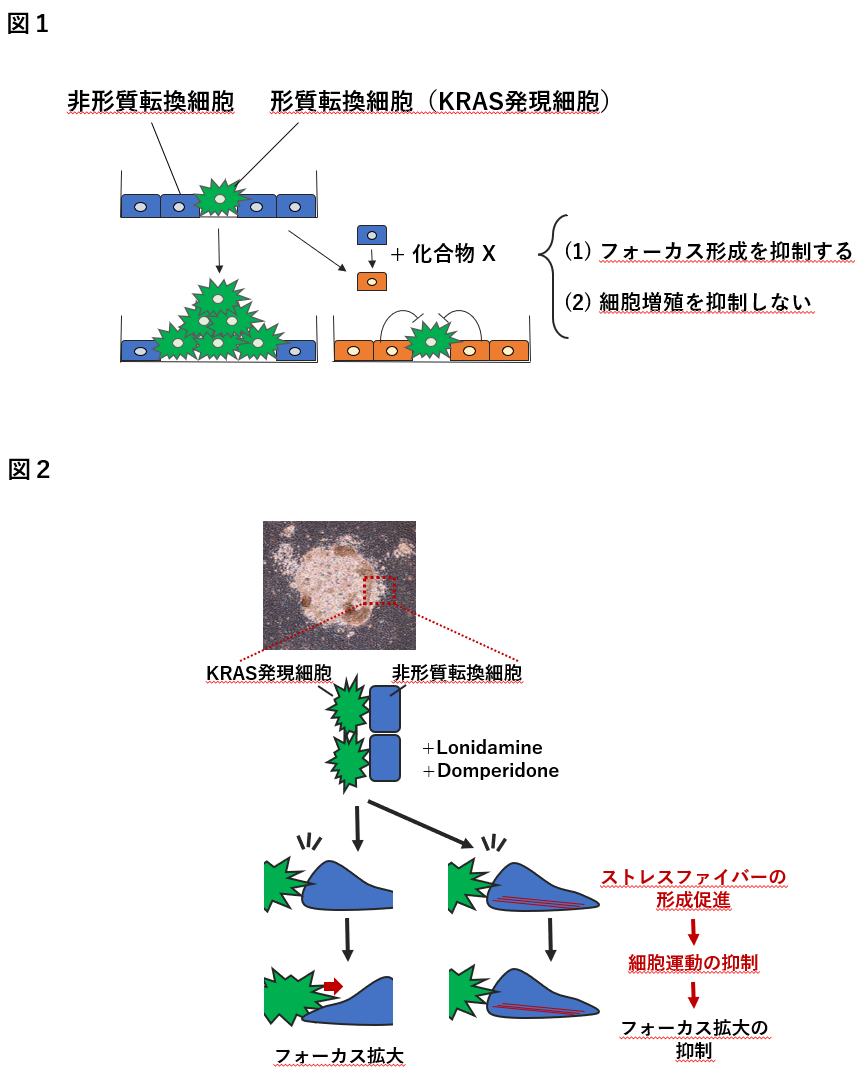
正常な細胞にはがん細胞の増殖を制御する仕組みが備わっており、この仕組みが破綻すると、がん細胞は正常な組織を破壊しながら増殖を続け、腫瘍を形成します。私たちは、ドキシサイクリン添加により活性型変異KRAS遺伝子を誘導発現させると形質転換する細胞(以下、KRAS発現細胞)と非形質転換細胞との混合培養を行なうことにより、形質転換細胞を取り囲む非形質転換細胞が形質転換細胞に与える影響を評価する培養系を確立しました。通常条件では、KRAS発現細胞は周囲の非形質転換細胞を押しのけるように増殖してフォーカスと呼ばれる細胞塊を形成します(図1)。この混合培養系を用いて、分子プロファイリング支援活動から供与いただいた標準阻害剤キットおよび理化学研究所天然化合物バンクに含まれる化合物を対象に、KRAS発現細胞によるフォーカス形成を抑制する化合物X(図1)のスクリーニングを行いました。(1) 非形質転換細胞とKRAS発現細胞を混合培養した際には、KRAS発現細胞によるフォーカス形成を抑制するが、(2)フォーカス形成を抑制した濃度で形質転換細胞やKRAS発現細胞の細胞増殖を抑制しない、という条件を満たすものをヒット化合物としました。その結果、標準阻害剤キットからはLonidamineを、理研NPDepoライブラリからはDomperdioneをヒット化合物として同定しました。
Lonidamine やDomperidoneは、いずれも標的とするタンパク質が報告されていますが、同じ標的タンパク質を阻害する他の阻害剤を用いて検討を行った結果、いずれも本現象には関与しないことがわかりました。また、Lonidamine やDomperidoneはフォーカスの拡大を抑制しますが、その抑制効果は可逆的であり、これら化合物は積極的にKRAS発現細胞の細胞死を誘導しているわけではないことがわかりました。そこで、フォーカスの拡大が抑制されるメカニズムとして、Lonidamine やDomperidoneによって細胞運動が変化することに着目しました。非形質転換細胞とKRAS発現細胞が対峙する場面において、通常条件では非形質転換細胞は、KRAS発現細胞の進行に合わせて後退りするような挙動を示します。一方で、Lonidamine やDomperidoneで処理すると、非形質転換細胞の後退りが見られなくなり、その場に止まることが観察されました。そこで、細胞運動を制御するアクチンで染色した結果、Lonidamine やDomperidoneで処理すると、非形質転換細胞の基底面側でストレスファイバーの形成が促進されることがわかりました。また、非形質転換細胞で細胞運動を制御するRhoAの活性型変異体を発現させてストレスファイバーの形成を促進させると、Lonidamine やDomperidoneの効果と同様にフォーカスの拡大が抑制される現象が観察されました。逆に、ドミナントネガティブ変異体を発現させると、Lonidamine やDomperidoneの抑制効果が部分的に解除されました。以上の結果より、Lonidamine やDomperidoneは、非形質転換細胞においてストレスファイバーの形成を促進することにより細胞運動を抑制し、その結果、KRAS発現細胞の進行を食い止めることによってフォーカスの拡大を阻害している可能性が示唆されました(図2)。
本研究は、正常細胞の”がん抑制”機能を強化するという新たながん治療法の可能性を示すものです。なお、この研究の後、Lonidamineの構造と活性の相関に関する解析も行い、発表しました (Aoyama, M., Homma, T., Koharazawa, R., Suhara, Y., and Semba, K. (2023). Effect of lonidamine derivatives on the inhibition of transformed cell area expansion. Biochem Biophys Rep 34, 101480)。一連の研究において、渡邉信元先生、平野弘之先生、長田裕之先生、須原義智先生、渡辺慎哉先生には、有意義なご議論、ご支援をいただきましたことに、感謝申し上げます。