筋萎縮性側索硬化症(ALS)発症の仕組みの一端を解明
-オプチニューリンの直鎖状ユビキチン鎖結合が神経炎症や細胞死を抑制する-
大阪市立大学大学院医学研究科 徳永文稔
Nakazawa, S., Oikawa, D., Ishii, R., Ayaki, T., Takahashi, H., Takeda. H., Ishitani, R., Kamei, K., Izumi, T., Kawakami, H., Iwai, K., Hatada, I., Sawasaki, T., Ito, H., Nureki, O., Tokunaga, F.
Linear ubiquitination is involved in the pathogenesis of optineurin-associated amyotrophic lateral sclerosis.
Nat. Commun. 7:12547 DOI: 10.1038/ncomms12547(2016)
https://www.nature.com/articles/ncomms12547
筋萎縮性側索硬化症(ALS)は、運動神経細胞(ニューロン)が侵されるため、筋力低下、歩行困難、構音障害(正常に発音しにくくなること)、呼吸不全に至る神経変性疾患で、残念ながら現在のところ有効な治療法はありません。ALS患者のほとんどは遺伝的な背景を有しない孤発性ですが、約10%は遺伝子変異が関連する家族性ALSであり、これまでに約20の関連遺伝子が同定されています。2010年に、日本の研究グループから家族性ALS関連遺伝子の一つとして、オプチニューリン(OPTN)遺伝子の変異が報告されています。現在、ALS発症メカニズム解明を目指して、これらの遺伝子の働きを明らかにする研究が懸命に進められているところです。
私たちは、LUBACと命名した酵素がユビキチンのN末端Met1を介した「直鎖状ユビキチン鎖」という特殊なユビキチン鎖を生成し、炎症や免疫に重要な転写因子であるNF-κBシグナル経路を選択的に活性化することを見出していました。ユビキチンは、多様な連結鎖を形成することで、タンパク質の寿命、細胞内局在、シグナル伝達、DNA修復など多彩な細胞機能を制御する小タンパク質です。
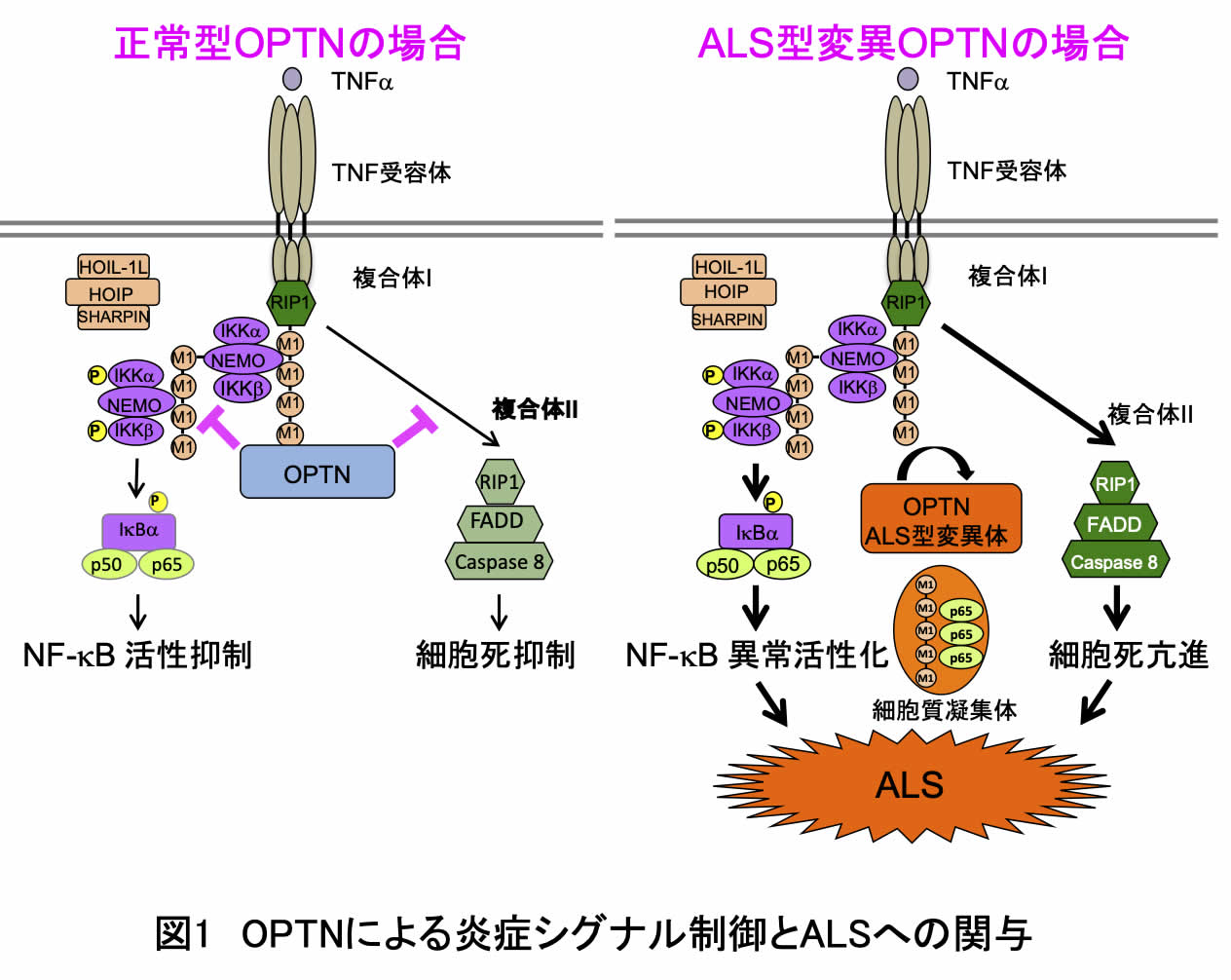
本研究で私たちは、疾患に関連することが知られていた12種のOPTN変異体を作製し、NF-κB活性化への影響を調べました。その結果、ALS関連のOPTN変異体では、本来OPTNが持っているNF-κB活性阻害能を失っていることを突き止めました。さらに、OPTNには直鎖状ユビキチン鎖に強く結合する領域(UBANドメイン)があり、ALS型変異体では直鎖状ユビキチン結合能が著しく低下していることが示されました。実際に、OPTN-UBANドメインと直鎖状ユビキチンとの共結晶構造も明らかにし、ALS型変異により直鎖状ユビキチン結合能を喪失する分子機構を解明しました。また、OPTN遺伝子を欠損した細胞では、刺激に伴うNF-κB活性化が亢進し、NF-κB応答抑制に伴う細胞死も亢進しました。そして興味深いことに、OPTN変異をもつALS患者由来の運動ニューロンでは、直鎖状ユビキチン鎖や活性化NF-κB因子(リン酸化p65)が細胞質封入体に局在していることを病理染色によって突き止めました。これらの結果から、正常型OPTNは直鎖状ユビキチン鎖との結合を介してNF-κB活性や細胞死を抑制し、細胞の生死に関わる重要なシグナル伝達経路を制御するが(図1左)、ALSを引き起こすOPTN変異体では、直鎖状ユビキチン鎖に結合できないためNF-κB活性が恒常的に亢進し、慢性的な神経炎症となり、患者運動ニューロンでは直鎖状ユビキチン鎖や活性型NF-κB因子(P-p65)が細胞内封入体に蓄積し、細胞死に至ることが示唆されました(図1右)。
ALS以外にもアルツハイマー病やパーキンソン病など多くの神経変性疾患でユビキチン陽性の封入体が形成されることが知られています。これまではその原因として、折りたたみ異常タンパク質が適切に分解されず凝集・蓄積し、細胞毒性を発揮していると考えられていました。一方、本研究から、神経変性疾患の細胞内封入体には直鎖状ユビキチン鎖を含む多様なユビキチン連結鎖が含まれており、分解だけでなく神経炎症、細胞死などの病因として機能する可能性が初めて示されました。これは、各種神経変性疾患の発症基盤として普遍的に寄与している可能性があります。また、直鎖状ユビキチン鎖生成を抑制する化合物は、神経炎症を抑制することでALS発症を防ぐ可能性があり、LUBAC阻害剤は創薬標的として有望と考えられます。
本論文成果は、読売新聞(2016年8月25日夕刊、大阪版・東京版)に紹介されました。