生体内初期化はKras 依存性発がん、特に膵発がんを促進する
岐阜大学大学院医学系研究科耳鼻咽喉科学分野 柴田 博史
Shibata H, Komura S, Yamada Y, Sankoda N, Tanaka A, Ukai T, Kabata M, Sakurai S, Kuze B, Woltjen K, Haga H, Ito Y, Kawaguchi Y, Yamamoto T, and Yamada Y.
In vivo reprogramming drives Kras-induced cancer development.
Nat Commun. 9, 2081 DOI:10.1038/s41467-018-04449-5 (2018).
https://www.nature.com/articles/s41467-018-04449-5
今回の研究の主目的はiPS細胞技術を用いて成人発がんのメカニズムを解明することでした。特に、Kras 依存性発がんに対するエピゲノム変化の影響を検討する目的で、膵発がんモデルマウスを作製し研究を行いました [Shibata et al. Nature Communications 2018:9:2081]。一般的にがんは遺伝子変異の蓄積で生じるとされています。ヒトがん組織の遺伝子解析や、リバースジェネティクス技術を用いた様々な発がんモデルマウスでの検討からこのことが証明されてきました。近年では、これら遺伝子変異に加え、遺伝子の使い方を規定する仕組みであるエピゲノムも発がんに重要であることがヒトがん組織の次世代シークエンスを用いた解析などから示唆されてはいるものの、これを直接的に示すことはできていませんでした。2006年に山中伸弥先生が報告されたiPS細胞作成技術は、多能性細胞に高発現している転写因子セット(Oct3/4, Sox2, Klf4, c-Myc の4つ。OSKM、初期化因子、山中4因子などと言われる)を人工的に強制発現することで分化細胞に脱分化を誘導し、iPS細胞(induced Pluripotent Stem Cells, 人工多能性幹細胞)を誘導する技術です。転写因子というのは遺伝子の調節領域に結合して遺伝子の発現具合、つまり使い方を変える因子で、エピゲノム変化を通じ細胞の分化状態を変化させうる働きがあります。iPS細胞作成の過程においては、新たな遺伝子変異を必要とせず、あくまで遺伝子の使い方(エピゲノム)のみを改変することでいわゆる’脱分化’をきたし多能性細胞が誘導されます。さらに、iPS細胞誘導過程においては、誘導開始2-3日で分化細胞の分化状態消失、その後誘導開始から1週間程度経過すると徐々に多能性細胞類似状態が誘導され、2週間程度で完全初期化されます(図1)。我々はこの技術を用いて、発がん過程にエピゲノム変化がどのように作用するかを検討しました。
膵がん(Pancreatic ductal adenocarcinoma: PDAC)の90%以上にKRAS変異が見られ、KRAS変異はPDACのドライバー変異であると考えられています。さらに、発がんの過程でCDKN2A 欠失, p53やSMAD4の不活化などが蓄積しておこるいわゆる’多段階発がん’の代表モデルであると理解されてきました。最も有名な発がんモデルでは、マウス膵臓特異的にKras, p53変異を誘導すると、生後2-3か月経過後に膵がんが発生するというモデルです。この発がんモデルマウスの膵がんではpERK 蛋白の発現が認められ、MAPK経路が活性化していることが示されています。
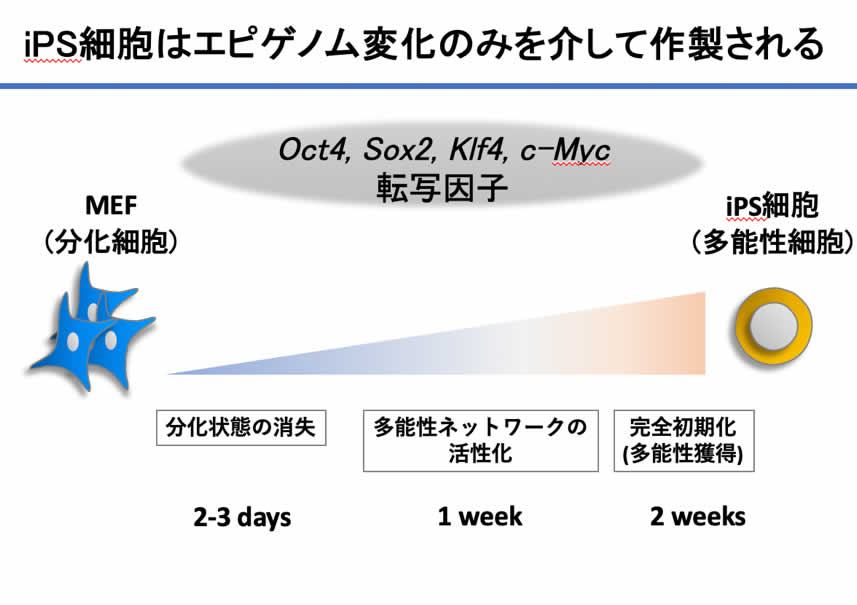
(図1) iPS技術はエピゲノム変化のみを介して脱分化を誘導できる
1) 膵発がんにはKras, p53変異だけでは不十分で、他の異常が必要である
我々はまず、膵がんモデルマウスを用いて、発がんを詳細に検討しました。Pdx1-ires-Cre マウスを作成し、Rosa LSL-LacZマウスと組み合わせて組み換え効率を評価すると、膵臓のほぼ全ての細胞がLacZ染色で青く染まり組み換えが起きていることが分かりました。さらにLSL-Kras G12D, LSL-p53 R172Hマウスと組み合わせて膵臓特異的にKras, p53遺伝子変異を発現させうるモデルマウスを作成しました。生後6週間の時点で評価すると、Kras, p53変異が膵臓のほぼすべての細胞で発現しているにも関わらず、膵臓細胞は病理学的に正常でした。膵臓細胞ほぼ全ての細胞でKras, p53変異が発現していることはサザンブロッティングでも確認しました。さらに、LSL-HA Kras G12Dマウスを作成し、HA-tag免疫染色でも膵臓のほぼすべての細胞にKras 変異が発現していることを確認しました。このマウスは生後2-3か月程度経過すると膵臓のごく一部に前がん病変または膵がんを発症し、既報と同様の結果でした。このことから、膵臓細胞にKras, p53変異が発現していてもすぐには発がんに至らない、言い換えると膵発がんにはKras, p53変異のみでは不十分で、他の異常が必要であることが示唆されました。一般にがん組織は起始細胞の分化度を種々に喪失していることが多い(脱分化)ことから、我々はiPS作成技術を用いてエピゲノム変化を誘導し脱分化をおこすとどのようなことが起こるか検討しました。
2) 膵臓特異的に初期化因子を短期間一過性に発現させると、エピゲノム変化を介して可逆性の脱分化を誘導でき、それは炎症でおこる状態と類似する
つぎに、我々は生体内で膵臓特異的に初期化因子を誘導するとどのようなことがおこるか検討しました。Pdx1 ires-Cre, Rosa LSL-rtTA3, Col1a1-tetO-OSKM ires-mCherry マウスを遺伝子組み換え技術を用いて作成しました。このマウスはドキシサイクリンを投与すると膵臓特異的に初期化因子を自在に誘導でき、さらにmCherry が発現して膵臓全体が赤く光ります (tet-ON システム)。qPCRで膵臓特異的な転写因子であるPtf1a, Mist1の発現変化を確認すると、初期化因子導入開始後わずか3日間で発現が急激に抑制され、さらに初期化因子の導入を一過性としドキシサイクリンの投与を1週間中止すると、初期化因子の発現が投与前のレベルに回復することが分かりました。細胞初期化の結果として脱分化をきたしていることが示唆されました。この現象に対するエピゲノムの関与を調べるために、次世代シークエンスを用いて網羅的にH3K27Acの発現を解析すると、一過性の初期化因子導入で膵臓特異的に発現している遺伝子群のsuper-enhancer 部分でH3K27Acの発現が急激に抑制され、またこの変化は可逆性であることがわかりました。これらの結果から、膵臓特異的に短期間一過性に生体内初期化を誘導すると、エピゲノム変化を介して可逆性の脱分化を誘導できることが明らかになりました。さらに、マウス膵臓に一過性膵炎を誘導し、初期化因子を一過性に強制発現させた膵臓とエピゲノム状態を比較すると、非常に類似していることが示されました。
3) Kras, p53 変異存在下で一過性のエピゲノム変化を伴う脱分化がおこると膵発がんが起こる
次に、Kras 変異存在下で一過性のエピゲノム変化を伴う脱分化を起こすとどのようなことが起こるかを検討しました。上述のように、Kras変異が存在するだけでは生後6週間の時点でこのマウスは病理学的に正常な膵臓でした。しかしわずか3日間の一過性初期化を誘導して可逆性の脱分化を誘導すると、pERKの発現が著明に誘導され、しかもそれは初期化因子を止めても持続することが分かりました。病理学的には膵臓ほぼ全体で前がん病変と一部膵がんの発症を認めました。このことから、Kras 変異存在下でエピゲノム変異を介する可逆性の脱分化が起こると発がんが著明に促進されることが示されました。さらにKras, p53変異存在下で同様の実験を行うと、膵臓全体が膵がんとなり、Kras発がんに対するエピゲノム変化の重要性を示すことができました。以上の結果から、Kras, p53変異のみでは発がんに不十分で、そこに一過性のエピゲノム変化を伴う脱分化がおこると発がんに十分であることが示されました(図2)。
4) 膵発がんはエピゲノム状態を正常に保つことで抑制できる可能性がある
逆に捉えると、たとえKras, p53変異が存在していても、エピゲノム状態を正常に保っていれば膵臓発がんが抑制できる可能性が示唆されます。そこで、我々はKras, p53変異存在下で一過性に脱分化を起こしたうえで膵臓特異的転写因子であるPtf1a, Mist1を強制発現し膵臓の分化状態を維持することを試みました。すると、pERKの発現が有意に抑制され、エピゲノム状態を保つことが膵発がんの抑制に繋がる可能性が示唆されました。

(図2) Kras発がん(特に膵がん)に対するエピゲノム変化の重要性
今回の研究成果はKras発がんモデルに対するエピゲノムの重要性を示したものです。膵がんモデルマウスを用いて今回の結論を導きましたが、発がんに対するエピゲノムの重要性は他のがん種でも明らかになりつつあり、今後はエピゲノム関連薬剤を用いたがん治療などへの応用が期待されます。この研究を遂行するに当たり、モデル動物作製支援を頂いたことにより、様々なモデルマウスをスムーズに作製することが可能でした。心より感謝申し上げます。

