持続的なリゾフォスファチジルコリンの上昇はP2X4受容体の活性化したミクログリアの集積を伴って放射線脳壊死を促進する
京都大学複合原子力科学研究所 近藤夏子
Kondo N, Sakurai Y, Takata T, Kano K, Kume K, Maeda M, Takai N, Suzuki S, Eto F, Kikushima K, Wanibuchi H, Miyatake SI, Kajihara T, Oda S, Setou M, Aoki J, Suzuki M. Persistent elevation of lysophosphatidylcholine promotes radiation brain necrosis with microglial recruitment by P2RX4 activation. Sci. Rep. 12:8718 doi: 10.1038/s41598-022-12293-3(2022).
https://www.nature.com/articles/s41598-022-12293-3
悪性脳腫瘍や頭頸部がんに対して放射線治療は標準治療として行われる。しかしX線に抵抗性を持つ悪性脳腫瘍や頭頸部がんは再発し、再照射が行われることがしばしばある。その際に、晩期有害事象(副作用)である放射線脳壊死や認知機能低下の発症リスクは上昇する。放射線脳壊死は発症すると慢性炎症を伴い不可逆的で、ステロイドなどの対症療法を行うが、効果は限られている。また放射線脳壊死に伴う脳浮腫の軽減に、抗Vascular endothelial growth factor 抗体薬bevacizumabは有効であるが、中断すると脳浮腫が再燃するため、より持続性のある根本的な治療が必要である。
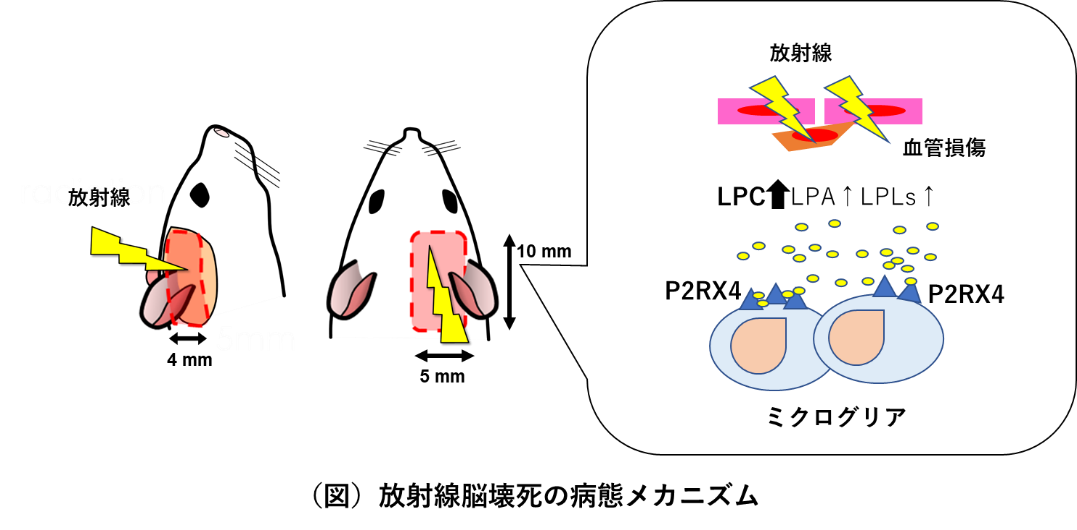
本論文は、放射線脳壊死に関するメカニズムと予防法についてマウスモデルを用いて検討した。マウス脳の右半分(5mm x 10 mm x 4mm (depth))に陽子線を照射した。このモデルは照射後慢性期(6~8か月後)にヒト放射線脳壊死の病理(微小出血・浮腫・凝固壊死など)と酷似する脳壊死を発症する。このモデルを用いて、発症と関係する脂質メディエーター・リゾリン脂質を調べた。リゾリン脂質は炎症時、細胞膜のリン脂質がphospholipase A2(PLA2)によって加水分解され生成し、特異的受容体に結合し病態に関与するが、遺伝子にコードされない。通常の遺伝子発現解析やその翻訳物質であるタンパクの解析では分析できないので、定量質量分析法LC-MS/MSによって解析した。するとホスファチジルコリンなどの前駆体のリン脂質は1か月をピークに上昇するが、その後慢性期には減少した。一方、リゾホスファチジルコリン(lysophosphatidylcholine: LPC)、リゾリン酸(lysophosphatidyl acid: LPA)や他リゾリン脂質は1か月以降も慢性的に上昇・高値維持しており脳壊死の病態と関連していることが予想できた。上昇したLPCやLPAはミクログリアやマクロファージを誘引することが知られる。本研究で用いたマウス脳壊死モデルで照射野に一致して、MSイメージングでLPC・LPAの上昇、病理組織でミクログリアが慢性的に集積していることを確認した。免疫組織染色でLPCの受容体P2RX4が、集積したミクログリアに発現が上昇しており、放射線脳壊死の病態にLPCによるミクログリアのP2RX4活性化が関与することが明らかとなった。炎症を促進するミクログリアの活性化を抑える目的でP2RX4作動薬・イベルメクチン介入試験を行った。イベルメクチンは自己免疫脳炎マウスモデルでミクログリアの炎症促進を抑えることが先行論文で発表されている。放射線脳壊死モデルに対するイベルメクチン介入試験は、病理学的にミクログリアの集積とP2RX4の発現を有意に抑制した。しかし、生存期間を有意に延長せず、作業記憶などの認知機能に有意な改善をもたらさなかった。原因を調べると、イベルメクチン投与によって、LPC以外のリゾリン脂質は減少していたが、LPCが減少していなかった。よってLPCを抑制することが肝要であることが明らかとなった。そのためには、LPC産生酵素PLA2または下流のATP・酸化ストレスシグナルを阻害することが必要だと考える。本研究によってLPC経路を標的にする放射線脳壊死の新たな治療戦略の可能性が拓けたので、今後はマウスモデルで検証し、放射線による脳壊死・認知機能低下を予防軽減する治療法を確立し臨床に活かしたい。本研究は脳に対する安全な再照射、QOLの向上・生存期間の延長に深く貢献すると考える。