皮膚化学発がんの原因遺伝子の同定と作用機序の解明
- Pak1の3’非翻訳領域の一塩基多型は選択的ポリアデニル化を調節し発がん感受性を変化させる-
千葉県がんセンター研究所 がんゲノムセンター 実験動物研究部
奥村 和弘
Okumura K, Saito M, Isogai E, Tokunaga Y, Hasegawa Y, Araki K, Wakabayashi Y.
Functional Polymorphism in Pak1-3' Untranslated Region Alters Skin Tumor Susceptibility by Alternative Polyadenylation.
J Invest Dermatol. 2022;142(9):2323-2333.e12, doi:10.1016/j.jid.2022.02.009
ヒト孤発性がんは、がん発症全体の約8割を占めます。今後、ヒト孤発性がんの原因遺伝子およびそれらの機能的な一塩基多型(SNP)の同定がヒトの発がん機序解明に重要となります。我々は、日本産野生由来近交系マウスMSM/Msの発がん抵抗性に着目し、DMBA/TPA多段階皮膚発がんモデルを用いた順遺伝学的手法により、がん感受性/抵抗性遺伝子の同定を目的とし研究を進めており、これまでにマウス染色体上に12個の候補遺伝子座(Skin Tumor Modifier of MSM:Stmmと命名)をマップすることに成功しました。
本研究では最も強く発がんに影響を与えるStmm1aの原因遺伝子の同定を試みました。まず、がん抵抗性系統のMSMと感受性系統のFVBの皮膚RNAを用いたRNA-seq解析によって、Stmm1a候補領域(約0.9 Mb)内の15遺伝子の発現を比較した結果、最も発現差がある遺伝子としてPak1を検出しました。Pak1はセリン・スレオニンキナーゼの1種であり、発がんドライバー遺伝子であるRASパスウェイの下流で働くシグナル調整因子です。また様々なヒトがん種でPAK1が高発現し、がん遺伝子的な機能を持つことが予測されています。MSMとFVBマウスのPak1の塩基配列を比較した結果、コーディング領域の非同義置換や直近のプロモーター領域にはSNPはなく、3’ 非翻訳領域(3’UTR)に5つのSNPが存在していました。そこで、この3’UTRのSNPに着目しin vitroレポーターアッセイによってスクリーニングを行いました。その結果、2つのSNP(Pak1-3’UTRの6番目C:FVBアレル/T:MSMアレルおよび171番目T:FVBアレル/A:MSMアレル)を候補SNPとして検出しました。
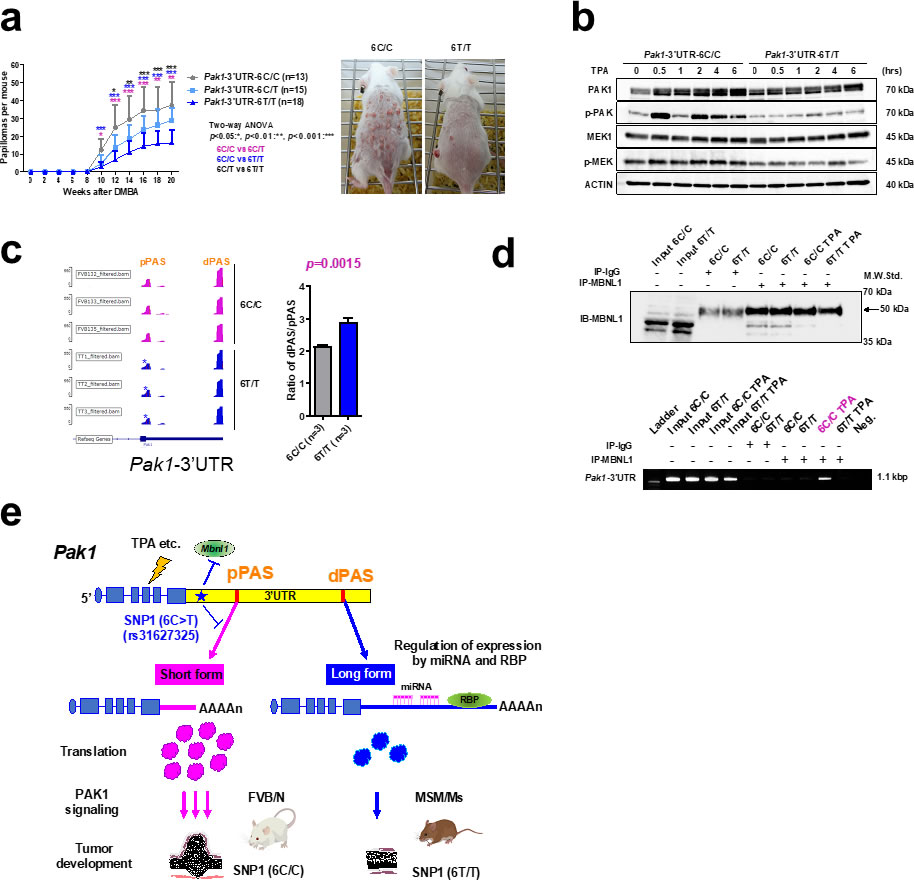
次にこれらのMSM型のSNPをCRISPR/Cas9法によって、それぞれFVBマウスに導入したPak1-3’UTR編集マウスを作製し、皮膚発がん実験を行った結果、Pak1-3’UTRの6番目C>T(6T/T)の置換が有意に皮膚腫瘍の形成を抑制することを明らかにしました(図a)。さらに6T/Tマウスの皮膚組織のPAK1のリン酸化状態を解析した結果、炎症誘発剤であるTPA処理後のPAK1発現量、PAK1の自己リン酸化および下流のMEKのリン酸化がすべて減弱していました(図b)。次にこのSNPによるPak1の発現調節の作用機序を検討した結果、当該SNPがPak1のポリアデニル化サイト(PAS)の選択的近位PAS(pPAS)の近傍にあることに注目しました。よって、我々はSNPがポリアデニル化に影響を与えると推測し、ポリA配列検出用にカスタムした3’mRNA-seqを実施しました。その結果、6T/TマウスではPak1-3’UTRのpPASのリード数が有意に低く、相対的に遠位PAS(dPAS)が多くなる、つまり3’UTRが長い転写産物が多いことが明らかになり、当該SNPによってPak1のポリアデニル化が変化することが分かりました(図c)。
さらに、データベース上でこのSNPの位置に結合するRNA結合因子を検索した結果、RNAプロセシング因子であるMBNL1がヒットしました。そこで、RNA免疫沈降(RIP)法によってMBNL1とPak1-3’UTRの結合を比較した結果、TPA処理後の6C/CにのみMBNL1との結合が検出され、6T/Tでは検出されませんでした(図d)。MBNL1はpPASの近傍上流に結合した場合、pPASのポリアデニル化を促進することがすでに報告されており、3’mRNA-seqの結果と一致していました。
以上のことから、我々は、Pak1がStmm1aの原因遺伝子の一つであること明らかにし、またPak1の3’UTRのSNPによる選択的ポリアデニル化を介した腫瘍抑制機構モデルを提案しました(図e)。6T/TマウスではTPA処理後にPAK1シグナルが減弱することやMBNL1の結合がTPA処理によって検出されることから、炎症などによる刺激と本機構が関連している可能性も考えられます。今後はヒトでも同様の機構が存在するかを明らかにすることで、新たながん予防や治療法の開発に貢献できると考えています。
図. Pak1-3’UTRのSNPはシス的制御を受け選択的ポリアデニル化を調節することで腫瘍発生に関与する.