TFE3 Xp11.2転座腎細胞がんモデルマウスの作製と解析
〜新規治療標的分子とバイオマーカーの発見と検証〜
熊本大学国際先端医学研究機構 馬場理也
Baba M, Furuya M, Motoshima T, Lang M, Funasaki S, Ma W, Sun HW, Hasumi H, Huang Y, Kato I, Kadomatsu T, Satou Y, Morris N, Karim BO, Ileva L, Kalen JD, Wilan Krisna LA, Hasumi Y, Sugiyama A, Kurahashi R, Nishimoto K, Oyama M, Nagashima Y, Kuroda N, Araki K, Eto M, Yao M, Kamba T, Suda T, Oike Y, Schmidt LS, Linehan WM.
TFE3 Xp11.2 Translocation Renal Cell Carcinoma Mouse Model Reveals Novel Therapeutic Targets and Identifies GPNMB as a Diagnostic Marker for Human Disease.
Mol Cancer Res. 17 (8), 1613-1626 Doi: 10.1158/1541-7786.MCR-18-1235 (2019).
http://mcr.aacrjournals.org/cgi/pmidlookup?view=long&pmid=31043488
Xp11.2転座型腎細胞がん(TFE3-RCC)は、成人腎細胞がん症例のおよそ2~5%と言われていますが、病理組織像の多様性や確定診断 (FISH又はTFE3免疫染色) の煩雑さから、少なからぬTFE3-RCCが見過ごされている可能性が考えられています。また、まとまった症例数が得難いこともあり、その生物学的特性や臨床経過の全容は未だ解明には至っておらず、進行例に対する治療方法は確立されていません。TFE3-RCCでは、X染色体上にある転写因子TFE3が転座により様々な融合遺伝子を形成しています。これまでにPRCC-TFE3, ASPSCR1-TFE3, SFPQ-TFE3, NONO-TFE3, RBM10-TFE3等、様々な融合遺伝子が報告されてきていますが、すべての融合TFE3たんぱく質は二量体形成とDNAへの結合に必要なbasic helix-loop-helix leucine zipper (bHLH-ZIP)構造を保持しており、これらの融合TFE3がoncogenicな転写因子として機能する事で発がんに寄与すると考えられています。
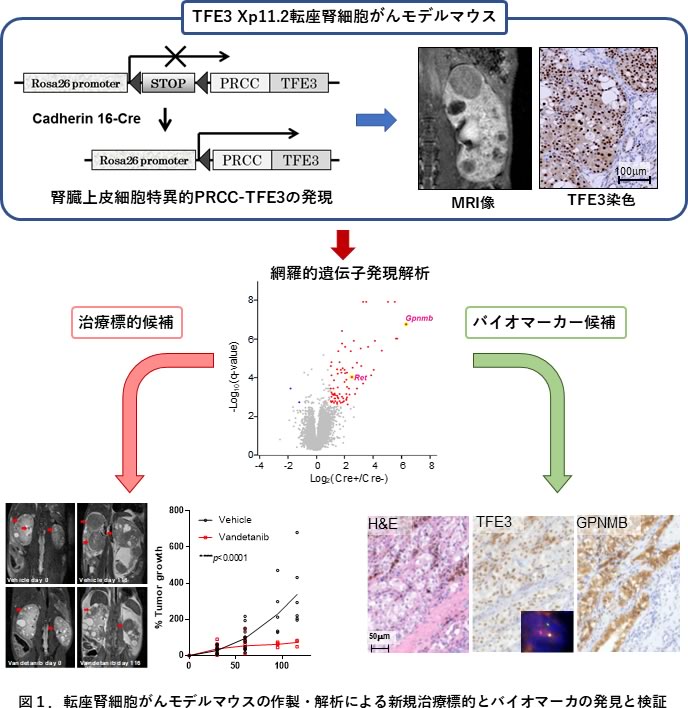
TFE3-RCCの発がん機構解明、バイオマーカーや治療方法開発のためにはTFE3-RCCモデルマウスを用いた解析が極めて有効と考えられますが、これまでにそのようなモデルマウスは存在しませんでした。そこで今回我々は、先端モデル動物支援プラットフォーム支援の下に、Xp11.2転座型腎細胞がん(TFE3-RCC)モデルマウスの作成と解析を行い、腎臓上皮細胞における融合TFE3の発現が腎細胞がん(RCC)を引き起こす事を示すとともに、TFE3-RCCの病理診断に有効なバイオマーカーの発見と検証、そして有望な治療標的分子候補の発見と阻害剤の有効性を検証しました。(図1)
融合TFE3を腎臓特異的に発現させるために、転写が恒常的にアクティブなRosa26プロモーターの下流にloxP配列で挟まれたネオマイシン耐性遺伝子とPRCC-TFE3のcDNAをノックインした遺伝子改変マウスを作製しました。このマウスをcadherin16プロモーターによりCreを発現するトランスジェニックマウスKSP-Creと交配する事で、腎臓尿細管〜集合管の上皮細胞特異的にPRCC-TFE3を発現させました。(図1)このPRCC-TFE3マウスは4ヶ月齢及び7か月齢において、尿細管上皮細胞の過形成や増殖亢進による嚢胞様変化、管腔内への腺腫様増殖、大小様々なサイズの固形腫瘍など、同一腎臓内に様々な形態の増殖性病変を示しました。固形腫瘍はエオシン好性の細胞や淡明細胞様の腫瘍細胞が多様な組織形態をとるとともに、砂粒体形成等のヒトTFE3-RCCに特徴的な組織像が再現されました。経時的なMRIにより計測した個々の腫瘍の増殖速度は多様であり、組織上の多様性を反映していると思われました。PRCC-TFE3マウスは上記尿細管上皮細胞の広範な異常増殖により加齢とともに腎不全を呈し、平均生存期間は11か月でした。また、大きな腫瘍を形成する個体も認めましたがRCCの転移は認めませんでした。
次に本モデルマウスを用いてバイオマーカーや治療標的分子を見出す目的で4ヶ月齢と7ヶ月齢のマウス腎臓を用いて網羅的遺伝子発現解析を行いました。Gene Set Enrichment Analysis (GSEA)ではPRCC-TFE3マウス腎臓においてRETシグナルの活性化や受容体型チロシンキナーゼシグナルの活性化が示唆されました。実際に受容体型チロシンキナーゼの中ではRETの発現がPRCC-TFE3マウス腎臓で有意に亢進しており、免疫染色でもPRCC-TFE3を発現している細胞に一致してRETの高発現が確認されました。そこでMRIで小腫瘍が確認されたPRCC-TFE3マウスをRET阻害作用のあるVandetanib投与群とvehicle投与群の2群に無作為に分け、投与開始時を含め経時的に計5回MRIによる腫瘍径の測定を行いました。Vandetanib投与群では有意に腫瘍の増大が抑制されました。(図1)以上より、このPRCC-TFE3マウスがTFE3-RCCの分子機構解明やバイオマーカー、治療標的探索だけではなく、前臨床モデルとしても有用であることが示されました。また、ヒトTFE3-RCCでも9例中7例(77.8%)でRETの免疫染色が陽性であったことから、進行TFE3-RCCの新規治療方法としてのRET阻害剤の有用性が示唆されました。
TFE3-RCCの診断のためには免疫染色でTFE3の核染色陽性やTFE3のbreak-apart FISHが必要ですが、TFE3の免疫染色は標本の固定や切片の保存状態などに影響を受け易く、疑陽性や偽陰性が多いのが問題であり、またTFE3 break-apart FISHがルーチンで行われている施設は限られています。日常の診療においてTFE3-RCCを見逃さないためにも、診断補助になるサロゲートマーカが必要です。このバイオマーカー候補として、PRCC-TFE3マウス腎臓で最も有意に高発現している分子としてI 型膜糖たんぱく質であるGpnmbに着目しました。ドキシサイクリン依存的にPRCC-TFE3を発現誘導するHEK293細胞を樹立し、PRCC-TFE3依存的にGPNMBの高発現が誘導されること、PRCC-TFE3がGPNMBのプロモーター領域にある2つのM-Box配列に結合し転写を直接活性化することを確認するとともに、9例のTFE3-RCC臨床検体全例において、GPNMB免疫染色の陽性を確認しました。一方で淡明細胞型腎細胞癌(CCRCC)では56例中1例、乳頭状腎細胞癌(PRCC)では20例中3例のみにGPNMB染色陽性を認めました。さらにTCGAデータベースを用いてCCRCC, PRCC, TFE3-RCCにおいて従来のTFE3-RCCサロゲートマーカの一つCTSKと共にGPNMBの発現レベルを比較しました。CTSKでは有意な差が認められませんでしたが、GPNMBはTFE3-RCCにおいて優位に発現レベルが高く、そのバイオマーカーとしての有用性が示唆されました。
以上の様に本研究では先端モデル動物支援プラットフォームの支援を受けてXp11.2転座型腎細胞がん(TFE3-RCC)モデルマウスの作成と解析を行い、その前臨床モデルとしての有用性を示すと共に、診断に有用なバイオマーカーの発見と検証、治療標的分子の発見と治療薬の検証を行いました。PRCC-TFE3を発現する腎臓は、尿細管の過形成や嚢胞、腺腫、更には大小様々で組織形が異なる固形腫瘍等、多様な組織像を呈し、あたかもRCCの多段階発がん過程を同一腎臓内に見ているかのようです。この事はPRCC-TFE3の発現だけでは発がんに必要充分では無く、起源となる細胞やその状態によるセレクション、ドライバー遺伝子変異の追加やエピジェネティックスな変化等の様々な要因が、TFE3-RCCの発がんには必要である事を示していると思われます。本モデルマウスを活用して更に研究を継続展開し、TFE3-RCCの発がん分子機構の解明に寄与したいと考えています。