SLFN11はリボゾーム生合成障害を介してTP53非依存的にアポトーシスを起こす
愛媛大学先端研究院プロテオサイエンスセンター・村井純子
Ogawa A, Izumikawa K, Tate S, Isoyama S, Mori M, Fujiwara K, Watanabe S, Ohga T, Jo U, Taniyama D, Kitajima S, Tanaka S, Onji H, Kageyama SI, Yamamoto G, Saito H, Morita TY, Okada M, Natsumeda M, Nagahama M, Kobayashi J, Ohashi A, Sasanuma H, Higashiyama S, Dan S, Pommier Y, Murai J.
SLFN11-mediated ribosome biogenesis impairment induces TP53- independent apoptosis
Molecular Cell, 85(5), 894-912.e10,2025, DOI:10.1016/j.molcel.2025.01.008
https://doi.org/10.1016/j.molcel.2025.01.008
[背景]
がん化学療法は50年以上にわたり使用されていますが、その効果には個人差があり、副作用もしばしば深刻です。したがって、治療開始前に「誰に効くか」を見極めることが望まれます。しかし、多くの化学療法剤では効果を予測するバイオマーカーが確立されていません。2012年頃から、SLFN11(Schlafen 11)の発現量がDNA障害型抗がん剤の感受性(効きやすさ)を予測する有力な候補として注目されています。これまで卵巣がん、肺がん、乳がんをはじめとする多数のがん種で、SLFN11高発現の腫瘍は化学療法に良好に反応することが報告されています。SLFN11は遺伝子変異による失活の報告はほとんどなく、その発現量こそが薬剤感受性を規定する重要な要因です。ただし、発現制御機構や具体的な作用メカニズムには未解明の部分が残されています。本研究では、SLFN11がリボソームRNA転写を抑制し、リボソーム生合成障害を介してアポトーシスを起こし、DNA障害型抗がん剤の効果を高める新たなメカニズムを明らかにしました。また、AdAMS分子プロファイリング支援により、約7割のがん細胞株で、このメカニズムによると解釈できる細胞死が起きることが明らかとなりました。
[研究結果]
リボゾームRNA(rRNA)とがん細胞のタンパク質合成
rRNAは、タンパク質合成の場であるリボゾームの構成要素であり、全ての細胞にとってその合成は不可欠です。特に、がん細胞では急速な増殖に伴いタンパク質合成が非常に活発であり、その結果、rRNAの合成も盛んに行われています。rRNAの合成は細胞核内の核小体で行われるため、この過程を標的とした研究はこれまでも活発に行われてきました(図1)。
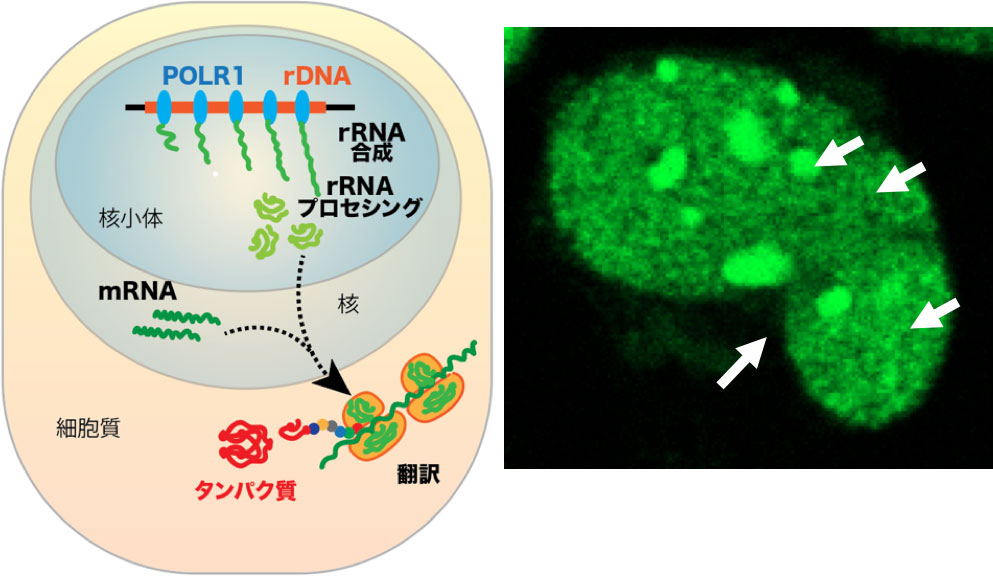
図1:核小体はrRNA合成の場であり、rRNAはリボゾームの構成要素となる(左)。ヒトがん細胞における、活発なrRNA合成(右)。緑で強く染まっている部分(矢印)が核小体。試薬を使って新規(1時間)に合成されたRNAを緑色に可視化している。
薬剤投与下でSLFN11がアポトーシスを起こすメカニズム
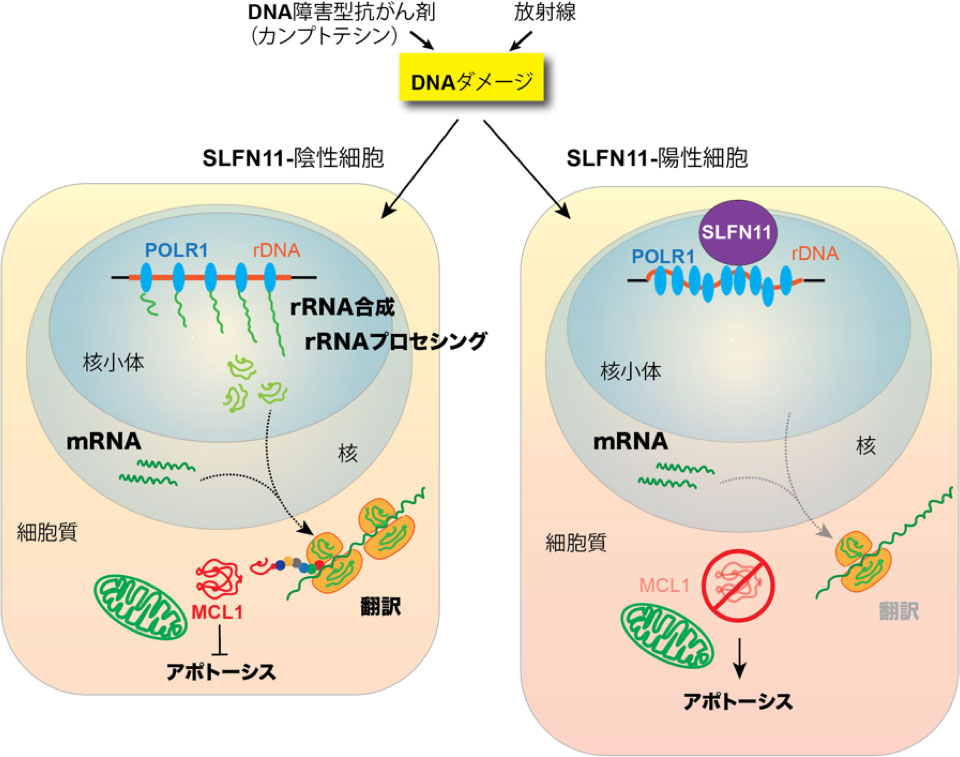
今回の研究では、DNA障害型抗がん剤の投与により、SLFN11が核小体におけるrRNA合成を低下させることを発見しました(図2)。
この結果、リボゾームの機能に異常が生じ、タンパク質合成が著しく低下することが判明しました。特に、半減期が短いタンパク質は、SLFN11の機能が発揮されてからわずか4〜6時間以内にタンパク質レベルが劇的に減少しました。これらの激減するタンパク質の中には、ミトコンドリア周囲でアポトーシスを抑制しているMCLタンパク質が含まれていました(図3)。
その他、様々な検証の結果、薬剤投与によってSLFN11が機能すると、リボゾーム機能の障害が起こり、タンパク質合成(翻訳)が低下し、MCL1の劇的な減少がアポトーシスを誘導する新たな経路が明らかになりました(図4)。
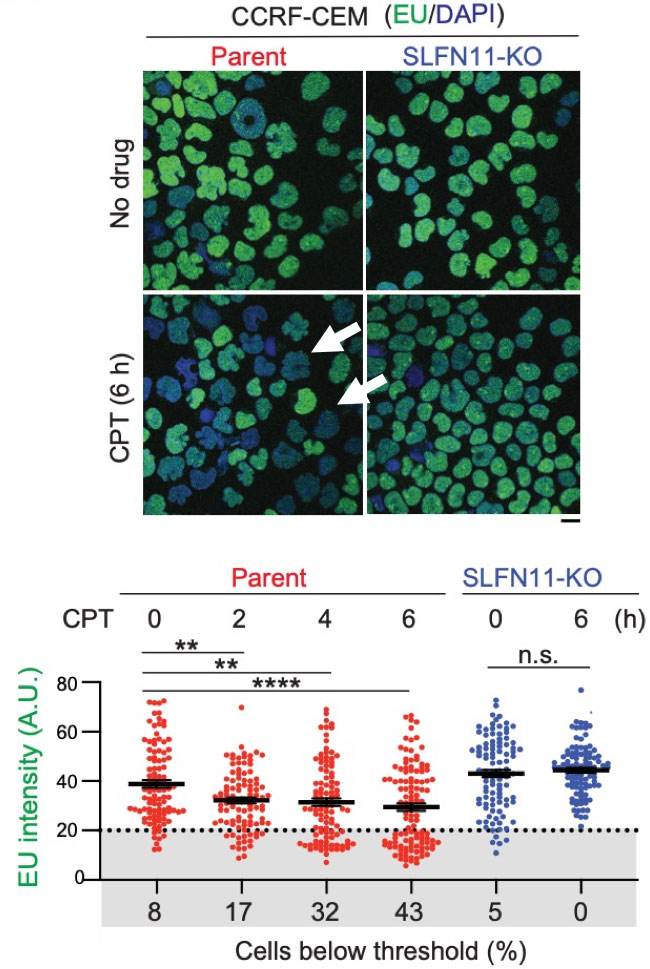
図2:ヒトリンパ腫由来のCCRF-CEM細胞はSLFN11の発現量が高い(Parent)。その細胞からSLFN11遺伝子ノックアウト細胞を作出した(SLFN11-KO)。これらの細胞を用いて、薬剤なし(No drug)と薬剤あり(CPT:カンプトテシン)の条件で、RNA合成量をEU(RNA構成要素のウラシルの類似物質)の取り込みで計測した。SLFN11を発現するParent細胞では、CPT投与6時間後にEUの取り込み(RNA合成)が極端に低下する細胞が、43%出現した(上、白矢印)。一方、SLFN11-KO細胞では、EUの取り込みが低下した細胞はまったく現れなかった(上、下)。EUの取り込みが低下した細胞は、CPT投与2、4、6時間と時間が経つにつれて増加した(下)。
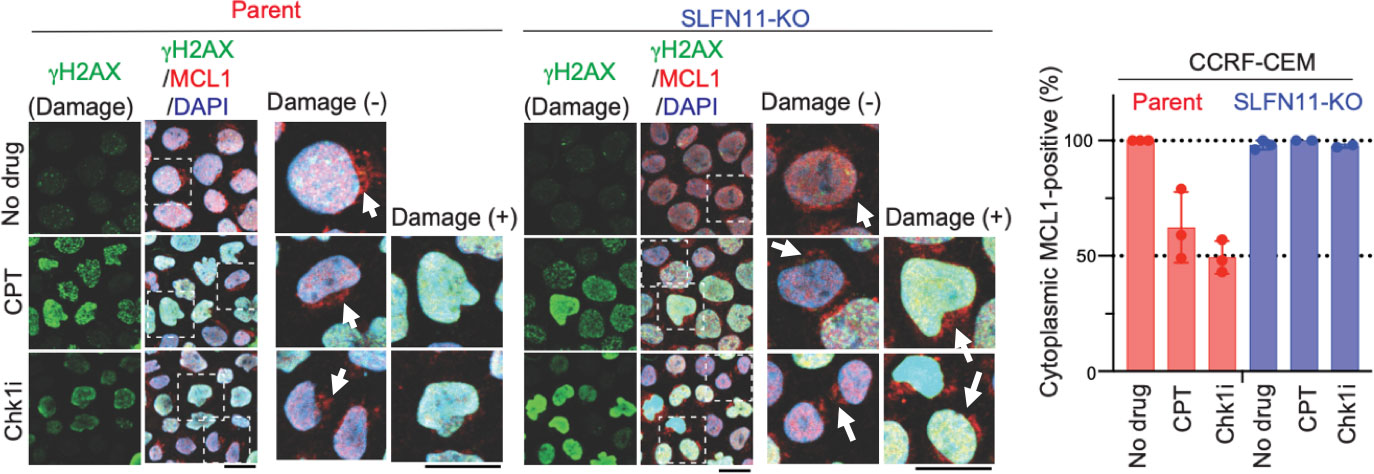
図3:図2と同じ細胞を用いて、薬剤なし(No drug)と薬剤あり(CPT:カンプトテシンまたはChk1i:チェックポイント1阻害剤)の条件で、DNAダメージ( H2AX)とMCL1を蛍光免疫染色で可視化した。 H2AXは緑色、MCL1が赤色(矢印)に染まっている。SLFN11を発現するParent細胞では、薬剤投与によってDNAダメージを受けた細胞(緑)はMCL1が消失した(左から4列目)。一方、SLFN11-KO細胞では、DNAダメージを受けた細胞(緑)もMCL1が検出された(左から8列目)。SLFN11を発現するParent細胞でも、DNAダメージを受けていない細胞ではMCL 1が検出された(左から3列目)。右のグラフはMCL1が検出できた細胞の割合(%)である。
本研究で明らかになったSLFN11依存的アポトーシスの一般化の検討
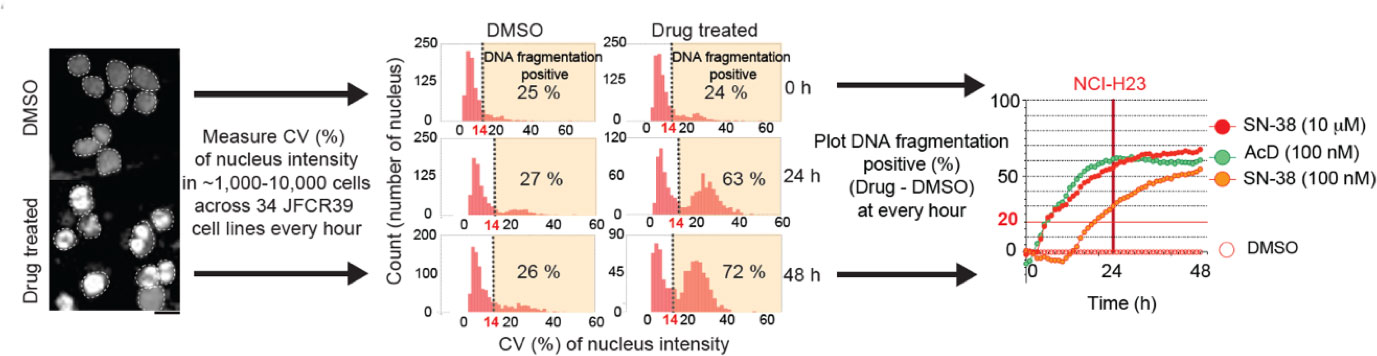
本論文のFIG 1―FIG 6では、主にリンパ球由来の特定の細胞を用いました。接着細胞を含めて、本経路がどの程度の割合のがん細胞に適応できるかを、AdAMS分子プロファイリング支援のもとでJCFR39ライブラリーを用いて検討しました。JCFR39株のうち、16株がSLFN11陽性、15株がSLFN11陰性、3株がどちらでもない(ambiguous)、5株は未検討となりました。AdAMSの磯山先生、旦先生が立ち上げた、アポトーシスを1時間毎に48時間まで測定する系(図5)で検討したところ、SLFN11陽性16株のうち、図4の経路でアポトーシスを起こすと解釈できる細胞株が11株(約7割)あることがわかりました(本論文のFIG 7で提示)。
学術的および臨床的な意義
SLFN11の発現検査は、臨床現場で広く用いられている病理検査(免疫組織検査)で簡便に行うことができ、検査費用も比較的安価なため、汎用性が期待できます。さらに、将来的には血液循環がん細胞(がん組織から剥がれて血液を流れる腫瘍細胞)を用いることで、複数回の解析やがんの病勢に応じた柔軟な治療選択が可能となると考えられます。SLFN11は、2012年以降、研究報告数は増加傾向にあるものの、これまでに発表された論文は約200報とまだまだ少なく、研究者数も限られています。本研究の成果は、DNA障害型抗がん剤の効果予測バイオマーカーとしてのSLFN11の重要性を医療関係者や一般社会に向けてアピールする上で、非常に意義深いものです。今後、SLFN11を活用したがん治療が実現すれば、多くのがん患者さんに対して、最適な治療法を提供できるようになり、がん医療の未来に大きな革新をもたらすことが期待できます。
先端モデル動物支援プラットフォーム(AdAMS)への謝辞
がん研究に限りませんが、新しく発見した現象を一般化するためには、偏りのない多数の細胞株で評価することが不可欠です。しかし、このような網羅的解析を個々の研究室レベルで行うのは費用や労力の面から極めて困難であり、今回、39種類ものがん細胞株を対象とした包括的な解析を可能にしてくださったAdAMSの支援を心から感謝申し上げます。とりわけ、実験計画の立案からアッセイ系の確立、実際の実験の遂行、さらに論文執筆に至るまで多大なご尽力をいただいた旦慎吾先生、磯山翔先生には、深く御礼申し上げます。