長鎖非翻訳RNA TUG1はDNAポリメラーゼηの発現亢進を介して卵巣がんのシスプラチン耐性を促進する
名古屋大学医学系研究科腫瘍生物学講座
薗部亮祐、鈴木美穂、近藤豊
Sonobe R, Yang P, Suzuki MM, Shinjo K, Iijima K, Nishiyama N, Miyata K, Kataoka K, Kajiyama H, Kondo Y
Long noncoding RNA TUG1 promotes cisplatin resistance in ovarian cancer via upregulation of DNA polymerase eta
Cancer Science,115(6),1910-1923,2024,doi:10.1111/cas.16150
https://onlinelibrary.wiley.com/doi/10.1111/cas.16150
卵巣がんは診断時にすでに進行している症例が多く、婦人科がんの中で最も予後不良の腫瘍です。標準治療としてはシスプラチンなどのプラチナ製剤を中心とした化学療法が行われますが、治療開始当初は奏効しても多くの症例で短期間のうちに耐性が生じます。そのため、再発卵巣がんでは有効な治療選択肢が限られ、臨床的に深刻な課題となっています。本研究は、この「シスプラチン耐性」という問題に焦点を当て、これまで検討されていなかった非コードRNAの関与を分子レベルで解明することを目的としました。特に、様々ながん種で腫瘍の進展や治療抵抗性に寄与することが報告されている長鎖非翻訳RNA(lncRNA)の一つであるTUG1に着目しました。本研究では、TUG1がシスプラチン耐性に深く関与する分子機構を明らかにし、TUG1が新規治療標的として有望であることを示しました。
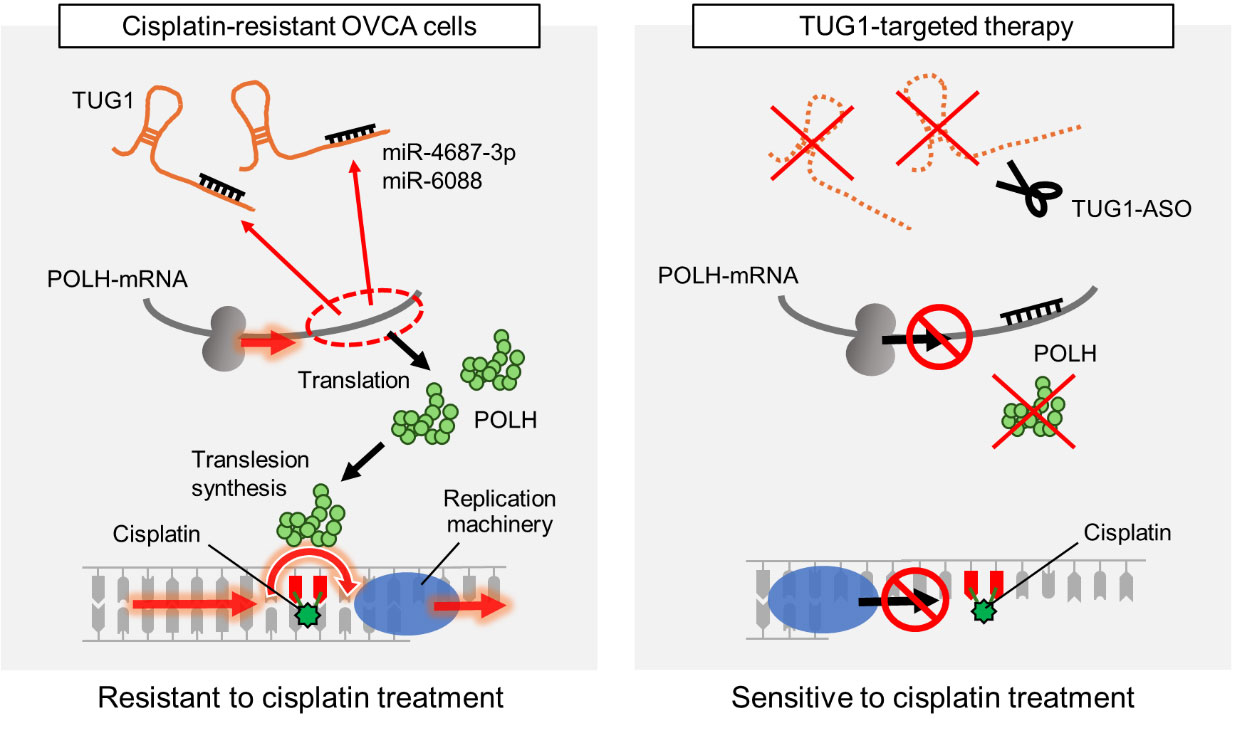
TUG1は近年、多くのがん腫で高発現していることが確認され、腫瘍進展や薬剤耐性に関与する可能性が示唆されています。その分子機能は多岐にわたり、私たちを含む複数の研究グループにより、核内でタンパク質との相互作用を介してDNA損傷応答や遺伝子発現を制御する役割が報告されています。一方で、細胞質ではmicroRNA (miRNA)と結合して翻訳制御に関与することが知られています。本研究では、卵巣がんにおいて細胞質に局在するTUG1が、miR-4687-3pおよびmiR-6088との結合を介してDNAポリメラーゼη(POLH)の発現を増加させ、損傷乗り越えDNA合成(translesion synthesis: TLS)によるDNA複製を活性化させることを証明しました(図)。これは、従来知られていなかった新たな分子メカニズムを示すものです。
図、miR-4687-3pとmiR-6088は、標的であるPOLHのmRNAに結合し、その翻訳を抑制します。一方、卵巣がん細胞でTUG1が高発現している場合、これら2種類のmiRNAはTUG1に結合し、POLHのmRNAへの結合が妨げられます。その結果、POLHの翻訳抑制が解除され、POLHの発現量が増加します。シスプラチンによって誘導されたDNA架橋は、POLHを介したTLS機構によって乗り越えられ、がん細胞はアポトーシスを回避します。これが、TUG1の高発現によるシスプラチン耐性獲得のメカニズムです(左図)。一方、TUG1-ASOによるTUG1標的治療では、miRNAがPOLHのmRNAに結合できるようになり、POLHの翻訳が抑制されます。その結果、シスプラチンへの感受性が高まることがわかりました(右図)。
研究の方法と結果(1):臨床検体の解析と、細胞株を用いた実験
はじめに、臨床検体の解析から、TUG1高発現症例がシスプラチン耐性および予後不良と関連することを見出しました。次に卵巣がん細胞株を用いた機能解析で、TUG1をアンチセンスオリゴヌクレオチド(ASO)で抑制するとシスプラチン感受性が顕著に上昇し、逆にTUG1を強制発現させると耐性が増強することを示しました。これにより、TUG1がシスプラチン耐性形成に直接寄与することが示されました。さらに分子機構の解明では、TUG1が細胞質でmiR-4687-3pおよびmiR-6088と結合し、これらのmiRNAによるPOLH抑制を阻害することが確認されました(左図)。POLHはDNA損傷を受けた鋳型でも複製を継続することができるTLSの中心的酵素であり、その活性化はシスプラチン耐性に関与することが報告されています。TUG1をASOで抑制すると、POLHの発現量は低下しました(右図)。この結果は、がん細胞で高発現する非コードRNAがmiRNA制御ネットワークを介してDNA修復経路を抑制するという薬剤耐性メカニズムを示しています。
研究の方法と結果(2):担がんマウスモデルを用いた治療実験
臨床検体における免疫組織化学解析では、POLH高発現とシスプラチン耐性、TUG1発現量の間に正の相関が確認されました。これは、実際の患者腫瘍組織においてもTUG1-miRNA-POLHの関係が成立していることを支持します。さらに、卵巣がん腹膜播種マウスモデルを用いたin vivo実験を行い、TUG1標的ASOをcRGDペプチド修飾ミセル型ドラッグデリバリーシステム(DDS)で腫瘍に送達すると、シスプラチン単独投与と比較してシスプラチン共処置群では腫瘍増殖を有意に抑制しました。このDDSはASOの腫瘍局所集積性と細胞内取り込み効率を高めるものであり、TUG1阻害の治療的有効性を裏付ける結果となりました。
今後の展開
本研究は、卵巣がんにおけるTUG1の役割を解明し、シスプラチン耐性形成における新規分子機構を明らかにしました。TUG1は卵巣がんに限らず他のがん種でも発現異常が報告されており、薬剤耐性やDNA損傷応答を制御する因子として広く機能している可能性があります。今後は、本研究で用いたASOの卵巣がんにおける臨床応用が期待されます。