ヒト神経変性疾患様症状をマウスで再現
―変異型Mitofusin 2の後天的発現は、行動異常を伴う進行性の神経変性を引き起こすー
筑波大学・生命環境系 石川 香
Ishikawa, K., Yamamoto, S., Hattori, S., Nishimura, N., Tani, H., Mito, T., Matsumoto, H., Miyakawa, T., and Nakada, K.
Acquired Expression of Mutant Mitofusin 2 Causes Progressive Neurodegeneration and Abnormal Behavior.
J. Neurosci. 39: 1588. DOI: 10.1523/JNEUROSCI.2139-18.2018. (2019)
https://www.jneurosci.org/content/39/9/1588.long
神経細胞は胎生期に劇的に数を増やし、出生後は刺激に応じて神経ネットワークを形成しながら機能的に分化し、成熟後は外界からの刺激に対して一定の可塑性を維持しながら生涯に渡って個体の行動や思考を制御します。つまり、神経細胞は発達段階に応じて異なるレベルの可塑性をもっていると考えられます。ヒトの神経変性疾患の多くは、成熟した後の神経回路が次第に侵されて老齢期に発症します。一方で、神経変性疾患のモデルとしてこれまでに樹立されている病態モデルマウスの大部分は、生まれつき病因因子をノックアウトまたは過剰発現されており、その影響を胎児期や若齢期から受け続けていて、ヒトの疾患とは病態形成の時期もメカニズムも異なっていると考えられます。神経変性疾患モデルマウスは、ヒトの病態進行をうまく再現できないものが多く、これが新規治療薬の評価や神経変性メカニズムの解明を困難にしている大きな要因の一つです。
ミトコンドリアはエネルギー合成を担う重要なオルガネラであり、細胞内で独自に融合・分裂を繰り返しています。Mitofusin 2(Mfn2)は、GTPase活性によってミトコンドリアの外膜同士をつなぎ、ミトコンドリア融合を担う実行因子で、その突然変異はCharcot-Marie-Tooth病という神経変性疾患の原因となることが知られています。つまり、Mfn2の突然変異は、神経変性を引き起こし得るということです。
そこで、Mfn2のドミナント・ネガティブ型変異体を神経細胞特異的に任意のタイミングで発現させることが可能なマウスを新たに樹立し、異なる発達段階の神経細胞に対するMfn2変異体発現の影響を調べることにしました。
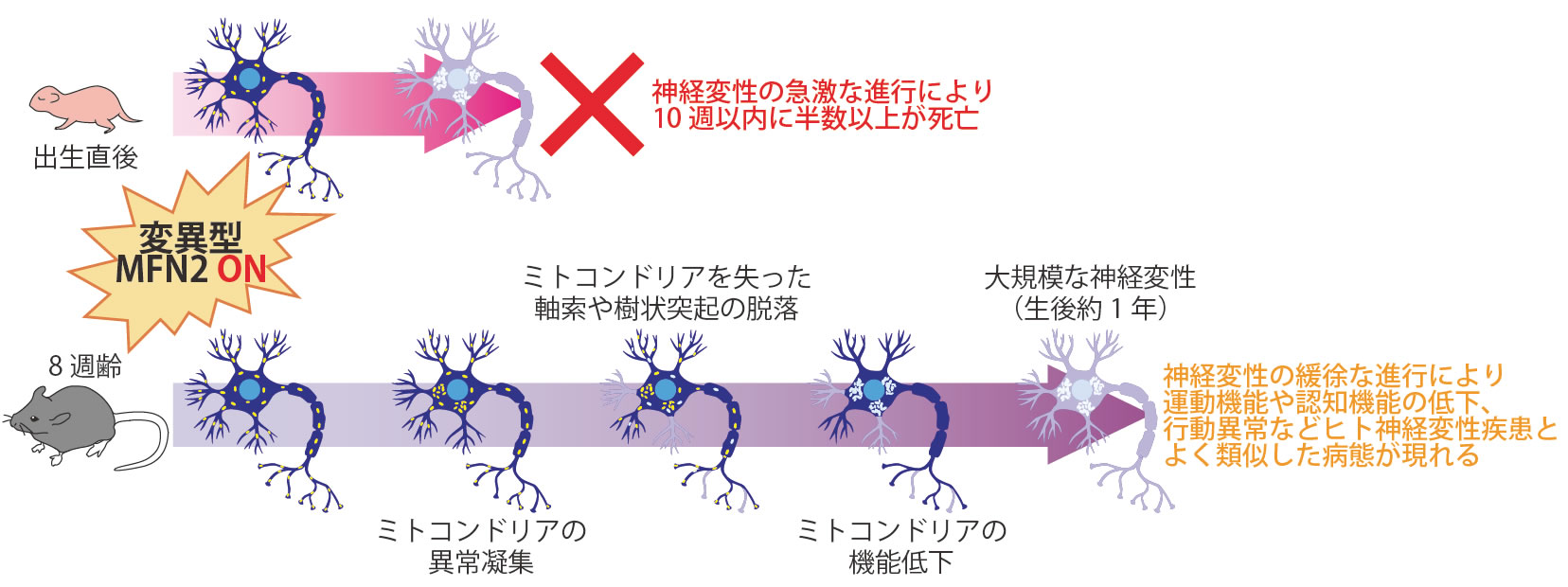
まず、変異型Mfn2を出生時から発現させると、速やかに急性の神経変性が誘導され、10週齢までに半数以上のマウスが死亡しました。
次に、マウスにおいて脳機能が一通り成熟する8週齢から変異型Mfn2を発現させました。しばらくの間は目立った表現型は現れませんでしたが、生後200日を過ぎた頃から体重増加が鈍くなり、生後300日以降は減少に転じました。ミトコンドリアの酸化的リン酸化を担う呼吸酵素複合体の活性や血糖値は徐々に低下し、生後200日頃までは野生型と同等だった脳重量も、生後350日の時点では有意に減少しました。生後350日時点の脳を観察すると、海馬は痕跡程度にまで萎縮しており、皮質も顕著に薄くなっていて、大規模な神経変性が起きたと考えられました。その一方で、生後350日までの観察期間において死亡率には野生型と有意な差はありませんでした。
観察された組織像から脳機能の低下が強く示唆されたため、網羅的な行動解析を実施したいと考え、AdAMSの生理機能解析支援に応募しました。藤田医科大学の宮川先生の研究室に全面的な協力を頂き、本マウスの生後300日以降の網羅的な行動解析を実施した結果、筋力や協調運動性の低下、特に夜間における異常な過活動、学習能力の欠如、作業記憶の顕著な低下といった異常が多数認められました。
徐々に神経変性が進行し、運動機能や記憶、学習能力に多大な影響を及ぼす一方で、直ちに生命を脅かすわけではないという表現型は、ヒトの老齢期以降に発症する神経変性疾患との共通点が多く、その進行を再現していると考えられます。
今回我々が樹立したマウスを用いた解析により、Mfn2の機能が神経細胞の維持に不可欠なものであることが明らかになりました。同じ遺伝子の同じ変異体であるにもかかわらず、生後すぐに発現させた場合と8週齢以降に発現させた場合で、現れた表現型に大きな違いがあったことから、神経細胞が同一ストレスに対しても発達段階によって全く異なる感受性を示すこともわかりました。同時に、若齢期のストレスと成熟後のストレスでは神経細胞に及ぼす影響が異なるということは、生まれつき病因因子がノックアウトされたり強制発現されたりしている既存のモデルマウスでは、成熟後に次第に神経細胞が侵されるヒト神経変性疾患の進行を再現することが困難であることも暗示しています。ヒトの神経変性疾患を真に模倣した優れた病態モデルマウスの樹立は、新規治療薬の開発にとっても、神経変性のメカニズム解明を目指す研究にとっても、大きな可能性をもたらす進歩となるはずですが、そのためには、病因因子のオンセットのタイミングも考慮したモデルの設計が重要であるということを、本研究は示唆しています。